
Наука в вашем кармане. История аккумуляторных батарей, отмеченных Нобелевской премией по химии 2019
---

Технологией, разработанной тремя ученым, пользуемся мы все, она всего за пару десятилетий изменила мир до неузнаваемости
Третий день Нобелевской недели, который в этом году выпал на 9 октября, по традиции – день химии. Именно в этой области сегодня присудили высшую научную награду. Ее в равных частях разделили американский ученый немецкого происхождения Джон Гуденаф, его соотечественник Стэнли Уиттингем и японский химик Акира Ёсино, которые создали технологию, изменившую мир до неузнаваемости – литий-ионную аккумуляторную батарею. Рассказываем об истории этого устройства и вкладе каждого из ученых словами самого Нобелевского комитета.
Нобелевская премия за 2019 год в области химии присуждена Джону Б. Гуденафу, М. Стэнли Уиттингему и Акире Ёсино за их вклад в разработку литий-ионных батарей. Эти перезаряжаемые аккумуляторные батареи стали основой бурного развития беспроводной электроники – мобильные телефоны и ноутбуки вошли в нашу жизнь именно благодаря им. Технология, поэтапно созданная трема выдающимися химиками, также открывает путь к миру, свободному от ископаемого топлива, поскольку теперь аккумуляторы используются повсеместно – от мощных электромобилей до накопления энергии, добытой из возобновляемых источников.
Уникальный элемент, открывший дорогу в будущее науки
Лежащий в основе разработки литий – один из древнейших химических элементов во вселенной. Он возник сразу же после Большого взрыва (его историю исследовал лауреат этого года в области физики Джеймс Пиблс). Человечество познакомилось с литием в 1817 году, когда шведские химики Иоганн Аугуст Арфведсон и Йенс Якоб Берцелиус выделили его из минерального образца, добытого в шахте на острове Утё, что на востоке Стокгольмского архипелага. Берцелиус назвал новый элемент в честь греческого слова "камень" – lithos. Несмотря на свое "тяжелое" название, это самый легкий твердотельный элемент, поэтому мы едва замечаем вес мобильных телефонов, которые сейчас носим с собой повсюду.
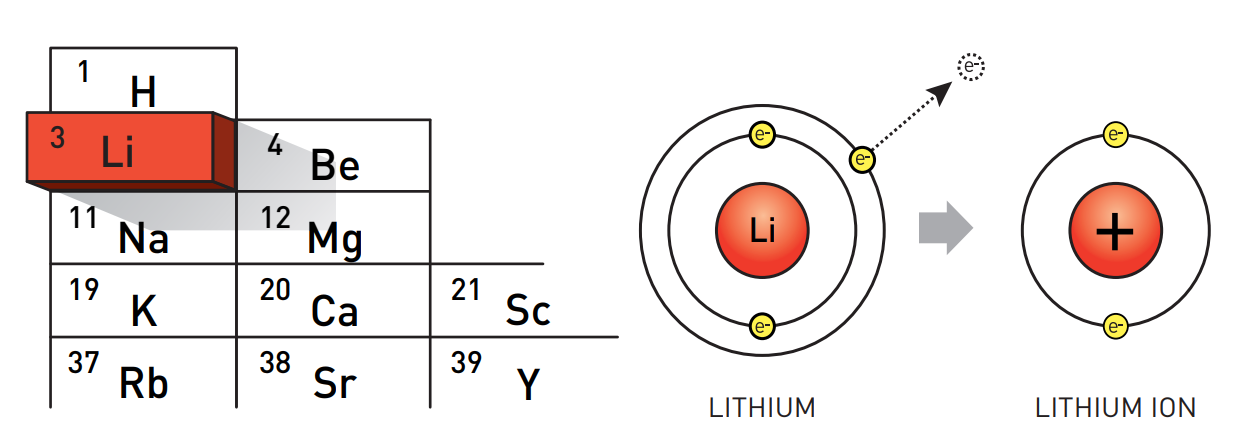
Литий – это металл. На его внешней орбите всего один электрон, который легко соединяется с каким-нибудь другим атомом. Когда это происходит, образовывается положительно заряженный и более стабильный ион.
Справедливости ради отметим, что шведские химики на самом деле выделили не чистый металлический литий, а его ионы в форме соли. Чистый литий – повод вызвать пожарную бригаду (о пожарных мы еще вспомним в ходе этой истории). Он является это нестабильным элементом, который необходимо хранить в масле, чтобы он не вступал в реакцию с воздухом.
Слабость лития – его химическая активность – также является и его силой. В начале 1970-х годов Стэнли Уиттингем использовал это его свойство, для высвобождения внешнего электрона элемента, когда разрабатывал первую функциональную литиевую батарею. В 1980 году Джон Гуденаф удвоил потенциал батареи, создав необходимые условия для увеличения ее мощности и эффективности. А в 1985 Акире Ёсино удалось убрать чистое вещество из батареи, полностью заменив его ионами лития, которые гораздо безопасней в использовании. Это сделало аккумулятор практичным и работоспособным. Литий-ионные аккумуляторы принесли человечеству большую пользу, поскольку они позволили разработать портативные компьютеры, мобильные телефоны, электромобили и хранить энергию, генерируемую от солнца и ветра.
Теперь мы вернемся на пятьдесят лет назад, непосредственно к началу истории литий-ионных батарей.
Бензиновый дым подстегивает исследования в сфере аккумуляторных технологий
К середине 20-го века количество автомобилей с бензиновым двигателем стало настолько большим, что их выхлопные газы заметно усугубили проблему смога, от которого страдали большие города. Это, а также осознание того, что используемая для производства топлива нефть является ограниченным ресурсом, стало вызывать тревогу как у производителей автомобилей, так и у нефтяных компаний. Чтобы выжить на рынке, им нужно было начать инвестировать в электромобили и альтернативные источники энергии.
Однако для всего этого требуются мощные аккумуляторы, способные хранить большое количество энергии. А на тот момент на рынке было только два типа аккумуляторов: тяжелый свинцовый аккумулятор, который был изобретен еще в 1859 году (и который до сих пор используется в качестве стартового аккумулятора в автомобилях с бензиновым двигателем) и никель-кадмиевый аккумулятор, разработанный в первой половине 20-го века.
Нефтяные компании инвестируют в новую технологию
Угроза истощения запасов нефти привела к тому, что нефтяной гигант Exxon решил диверсифицировать свою деятельность. Компания вложила крупные средства в фундаментальные исследования и привлекла ведущих ученых-энергетиков того времени, предоставив им свободу заниматься всем, чем угодно, если это не было связано с нефтью.
Британский химик Стэнли Уиттингем был одним из тех, кто стал работать под эгидой Exxon. Случилось это в 1972 году. Он приехал в США на работу в Стэнфордский университет, где исследовал твердые материалы, способные на атомарном уровне присоединять заряженный ион. Это явление называется интеркаляцией. Присоединение таких ионов меняет свойства материалов. В Exxon Стэнли Уиттингем и его коллеги начали исследовать сверхпроводящие материалы, в том числе дисульфид тантала, который может интеркалировать ионы. Исследователи добавляли ионы к этому веществу и изучали, как это влияет на его проводимость.
Уиттингем открывает чрезвычайно энергоемкий материал
Как это часто бывает в науке, работа Уиттингема привела к довольно неожиданному открытию. Неожиданному и ценному. Оказалось, что ионы калия влияют на проводимость дисульфида тантала, и когда Стэнли Уиттингем начал детально изучать полученный материал, то заметил, что он имеет очень высокую энергоемкость. Взаимодействия, которые возникали между ионами калия и дисульфидом тантала, были удивительно богаты энергией, и, когда он измерил напряжение материала, оно составило пару вольт – больше, чем у многих батарей того времени. Стэнли Уиттингем быстро понял, что пришло время сменить направление, перейдя к разработке новых технологий, которые могли бы накапливать энергию, необходимую для электротранспорта будущего. Тем не менее, тантал является одним из самых тяжелых элементов, а рынок не нуждался в еще одном виде тяжелых аккумуляторов. Тогда ученый заменил тантал на титан – элемент со схожими свойствами, но существенно меньшей массой.
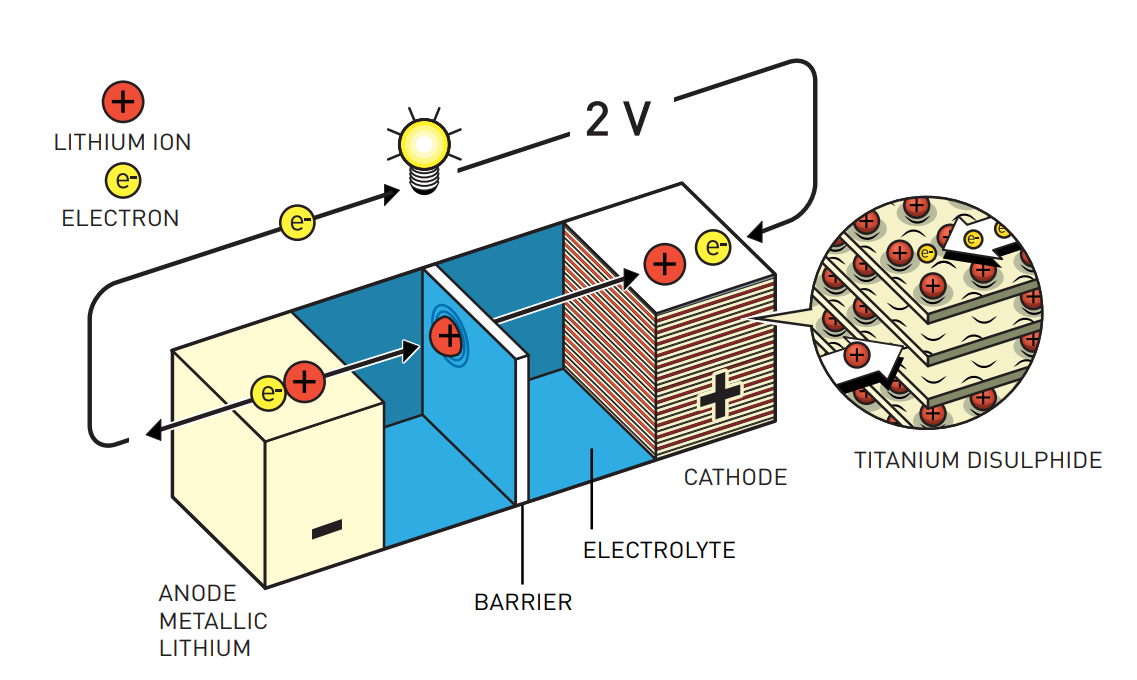
Первые аккумуляторы имели в электродах твердое вещество, которое разрушалось, вступая в химическую реакцию с электролитом. Это приводило к уничтожению батареи. Преимущество литиевой батареи Уиттингема в том, что ионы лития хранились в зазорах дисульфида титана в катоде. Когда батарея использовалась, ионы лития перетекали из лития в аноде в дисульфит титани в катоде. Когда батарея заряжалась, ионы лития снова текли обратно.
Литий в отрицательном электроде
Постойте, а где же в этой истории литий? А его Уиттингем использовал как отрицательный электрод в своей инновационной батарее. И выбор лития тут не был случайным. В батарее электроны должны течь от отрицательного электрода (анода) к положительному (катоду). Следовательно, анод должен содержать материал, который легко отдает свои электроны. А литий как раз принадлежит к тем элементам, которые запросто делятся своими электронами.
Результатом работы ученого стала перезаряжаемая литиевая батарея, которая работала при комнатной температуре и имела большое напряжение. Стэнли Уиттингем вместе со своей разработкой отправился в штаб-квартиру Exxon в Нью-Йорк на переговоры. Беседа длилась что-то около 15 минут – руководители компании быстро приняли решение взяться за создание батареи для коммерческого использования на основе открытия ученого.
Внезапные преграды – литий взрывается, а цены на нефть падают
Группа, которая взялась за разработку коммерческих батарей, довольно быстро столкнулась с трудностями. При многократной перезарядке от литиевого электрода начинали расти нитевидные "усы", которые тянулись к другому электроду. Рано или поздно они достигали своей цели, это приводило к короткому замыканию в батарее и взрыву. Пожарных приходилось вызывать настолько часто, что те пригрозили заставить лабораторию купить специальные химикаты, необходимые для тушения горящего лития.
Чтобы сделать батарею безопасной, ученые добавили алюминий к электроду из металлического лития, а также заменили в батарее электролит. В 1976 году Стэнли Уиттингем, наконец уверенный в своей разработке, объявил об открытии, а сами аккумуляторы стали в небольшом количестве производить для швейцарской часовой компании, которая изъявила желание использовать их для своих часов на солнечных батареях.
Дела шли хорошо, и исследовательская группа уже поставила себе следующую амбициозную задачу – увеличить емкость своего аккумулятора до такого размера, чтобы от него можно было запитать автомобиль. Но тут в начале 1980-х гг. случился обвал цен на нефть и компании Exxon пришлось сокращать расходы. Под программу экономии попали исследования группы Уиттингема. Впрочем, лицензию на технологию удалось продать трем компаниям в трех разных частях света. Так работу подхватил Джон Гуденаф.
Нефтяной кризис мотивирует Гуденафа взяться за разработку аккумуляторов
Джон Гуденаф родился в университетском городе Йена, который находится на территории современной Германии, но очень скоро переехал в США, где его отец получил образование, а затем стал преподавателем в Йельском университете. В детстве у Джона, который рос в колыбели науки, были проблемы с обучением чтению. Поэтому вместо букв он стал более внимательно присматриваться к цифрам и так полюбил математику. Отслужив после университета в армии, он решил посвятить свою жизнь еще и физике. Много лет Гуденаф проработал в Лаборатории Линкольна Массачусетского института технологий. За это время ученый успел сделать вклад в развитие технологии оперативной памяти RAM, которая по-прежнему является фундаментальным компонентом вычислительной техники.
Нефтяной кризис семидесятых ударил по Гуденафу, как и по многим гражданам США, это и побудило его заняться разработкой альтернативных источников энергии. Однако Лаборатория Линкольна финансировалась ВВС США, а это накладывало некоторые ограничения на направления исследований. Поэтому, когда ученому предложили должность профессора неорганической химии в Оксфордском университете в Великобритании, он решил рискнуть. И так начал свои исследования в сфере инновационной энергетики.
Ионы лития в оксиде кобальта и высокий вольтаж
Гуденаф был в курсе революционных разработок Уиттингема, но его специальные знания строения вещества подсказывали, что катод в батарее коллеги можно сделать более эффективным, использовав оксид металла вместо сульфида. Исследователи из его группы получили задание найти оксид металла, который вырабатывал бы высокое напряжение при интеркалировании ионов лития, но не разрушался бы после их удаления.
Ученый даже не подозревал, насколько успешной станет эта работа. Батарея Уиттингема генерировала более двух вольт, а Гуденафу удалось обнаружить, что аккумуляторная батарея с литий-кобальтовым оксидом в катоде была почти в два раза мощнее.
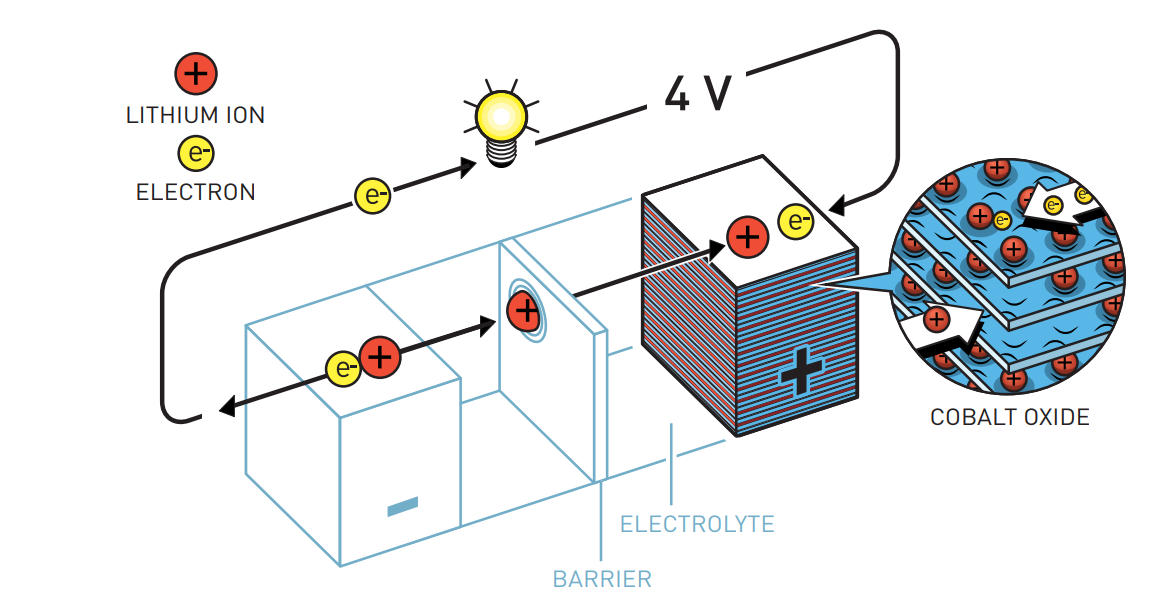
Гуденаф начал использовать оксид кобальта в катоде литиевой батареи. Это почти удвоило напряжение батареи и сделало ее гораздо более мощной.
Одним из ключей к этому успеху было осознание Джоном Гуденафом того факта, что батареи не нужно производить в заряженном состоянии, как делалось раньше, а заряжать позднее. 1980 году он представил открытие этого нового, энергоемкого катодного материала, который, несмотря на небольшой вес, увеличивал мощность и емкость аккумуляторов. И это был решающий шаг, который привел к беспроводной революции.
Японские компании желают для своей электроники легких батарей
С падением цены на нефть на Западе интерес к альтернативной энергетике и развитию электротранспорта тоже упал. В Японии же все было совсем иначе – здешние технологические компании отчаянно нуждались в легких перезаряжаемых батареях, которые могли бы питать инновационную электронику, такую как видеокамеры, беспроводные телефоны и компьютеры. Одним из ученых, сумевших вовремя разглядеть эту потребность, стал Акира Ёсино из корпорации Asahi Kasei. "Можно сказать, я унюхал направление, в котором двигались тренды", – пошутил он позднее.
Ёсино создает первый коммерческий литий-ионный аккумулятор
Когда Акира Ёсино решил разработать функциональную перезаряжаемую батарею, он использовал литий-кобальтовый оксид Гуденафа в качестве катода и попытался использовать различные материалы на основе углерода в качестве анода. Исследователи ранее показали, что ионы лития могут быть интеркалированы в молекулярные слои в графите, но электролит батареи разрушал графит. Момент кричать: "Эврика!" для Ёсино настал, когда он попробовал использовать побочный продукт нефтепромышленности – нефтяной кокс. Когда он зарядил это вещество электронами, ионы лития втянулись в материал. Затем, когда он включил батарею, электроны и ионы лития перетекали в сторону оксида кобальта в катоде, который имеет гораздо более высокий потенциал.
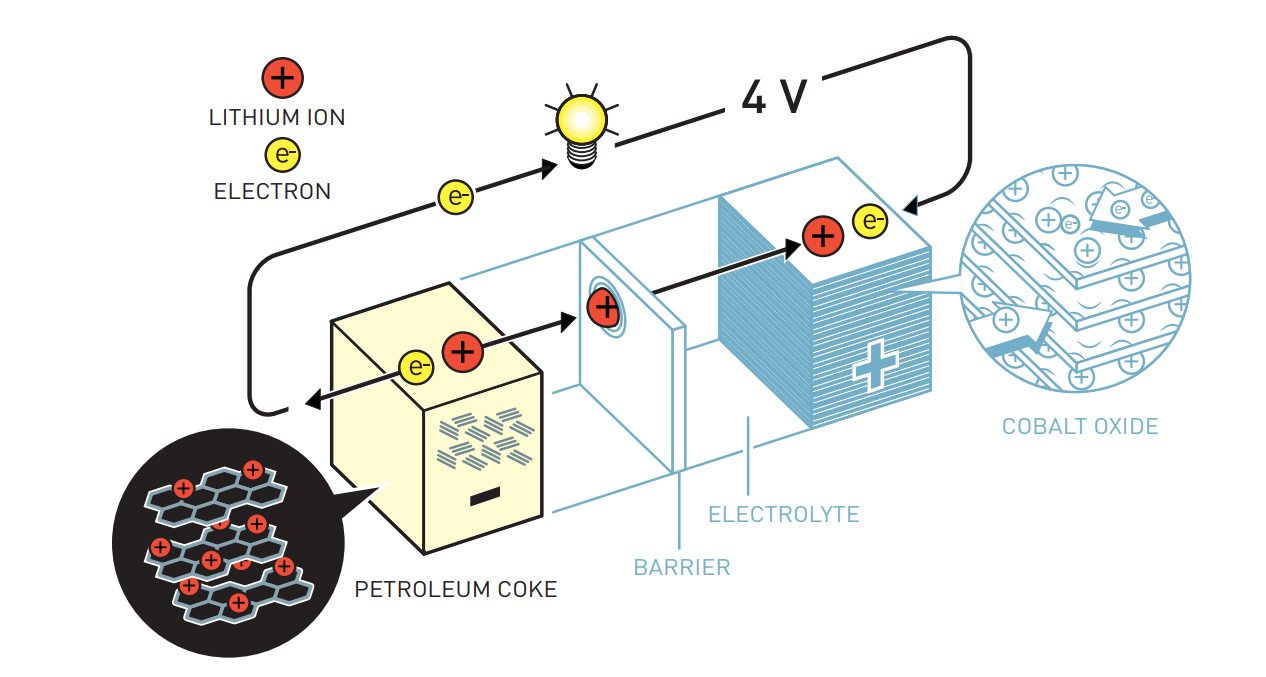
Акира Ёсино разработал первый литий-ионный аккумулятор для коммерческого использования. В катоде он использовал оксид лития и кобальта, разработанный Гуденафом, а в аноде – углеродный материал, нефтяной кокс, который также может интеркалировать ионы лития. Функциональность батареи не основана на каких-либо разрушительных химических реакциях. Вместо этого ионы лития текут взад и вперед между электродами, что продлевает срок службы батареи.
Разработанный Ёсидой аккумулятор оказался стабильным, легковесным, имел большую емкость и выдавал невероятные четыре вольта. Главным преимуществом литий-ионной батареи стало то, что ионы интрекалировались в электроды. Большинство других батарей основывались на химических реакциях, при которых электроды медленно, но верно заменялись. Когда же литий-ионный аккумулятор заряжается или используется, ионы перетекают между электродами, не вступая в реакцию со средой. Это означает, что аккумулятор имеет длительный срок службы и может заряжаться сотни раз, прежде чем его производительность ухудшится.
Еще одно большое преимущество разработки японского ученого заключается в том, что в его батарее нет чистого лития. В 1986 году, когда Акира Ёсино проверял безопасность батареи, он проявил осторожность и использовал установку, предназначенную для испытания взрывных устройств. Он бросил большой кусок железа на аккумулятор, но ничего не произошло. Когда такой же эксперимент провели с батареей, содержащей чистый литий, прогремел сильный взрыв. Этот тест на безопасность стал решающим в судьбе батареи. Акира Ёсино назвал его "моментом, когда родилась литий-ионная батарея".
Литий-ионный аккумулятор – серьезный шаг к будущему без ископаемого топлива
Одна из ведущих японских компаний по производству электроники начала продавать первые литий-ионные аккумуляторы в 1991 году. это привело к революции в электронике. Мобильные телефоны уменьшились в размерах, компьютеры стали портативными, появились MP3-плееры и планшеты.
Впоследствии ученые по всему миру искали в периодической таблице элементы для создания еще более качественных батарей, но никому пока не удалось придумать что-то, что могло бы сравниться с высокой емкостью и напряжением литиевой батареи. Тем не менее, литий-ионный аккумулятор все же был изменен и улучшен. Кроме прочего Джон Гуденаф придумал заменить оксид кобальта фосфатом железа, что сделало аккумуляторы более экологичными.
Как практически все, что производится в современном мире, литий-ионные батареи оказывают свое воздействие на окружающую среду. Но при этом они дают и огромные преимущества. Аккумуляторы позволили разработать экологически чистые энергетические технологии и электромобили, способствуя тем самым снижению выбросов парниковых газов и твердых частиц выхлопных газов.
Благодаря своей работе Джон Гуденаф, Стэнли Уиттингем и Акира Ёсино создали необходимые условия для общества, свободного от ископаемого топлива и проводов. И таким образом выполнили завещание Альфреда Нобеля – принесли человечеству наибольшую пользу.
Источник
Источник: nig.mirtesen.ru
Комментарии (0)
{related-news}
[/related-news]