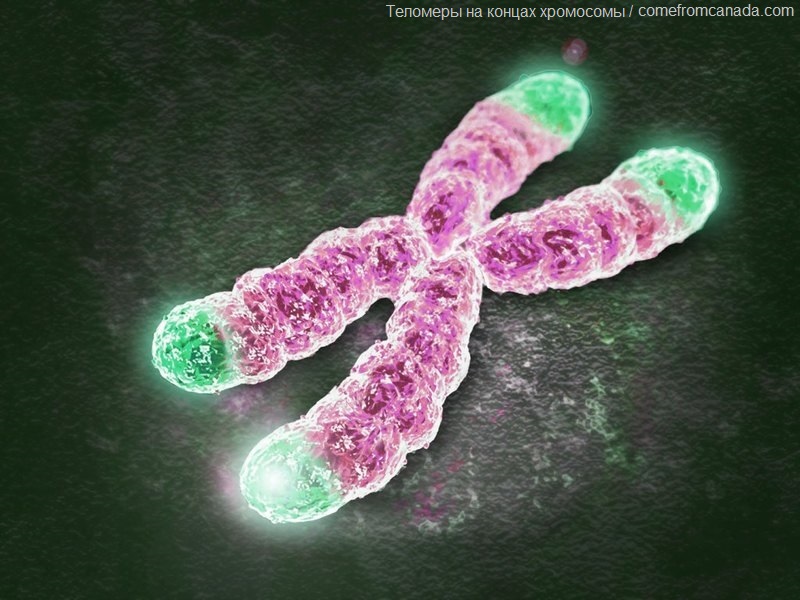
Предел Хейфлика и продолжительность жизни человека
---
С тех пор как в 2009 году Нобелевскую премию вручили за открытие механизма защиты хромосом теломерами, лаборатории по всему миру стали предлагать услугу исследования длины теломер с целью определения "биологического возраста". В чем суть этого открытия, влияет ли длина теломер на продолжительность жизни человека и стоит ли тратиться на данное обследование - об этом моя сегодняшняя статья.

Предел Хейфлика
В 1961 году Леонард Хейфлик, наблюдая за культивированием фибробластов человека, обнаружил гибель культуры после 50 делений. Клетки можно было переносить из среды в среду, замораживать на любой срок, но и после размораживания они каким-то образом "помнили" сколько уже произошло делений и делились столько раз сколько осталась до 50. Названное в честь ученого явление - предел Хейфлика - годами оставалось необъяснимым, но уже тогда заговорили про запрограммированную в генах продолжительность жизни человека.
Лишь в 1971 году Алексей Оловников обратил внимание, что предел Хейфлика характерен для клеток с незамкнутой в кольцо ДНК, в то время как бактерии с кольцевой ДНК размножаются без ограничений. Ученый выдвинул гипотезу маргинотомии, которая предполагала, что лимит деления клеток с линейной ДНК обусловлен неполным копированием концевых участков хромосомы в момент деления клетки. Идея Оловникова гениальна и одновременно проста, ее легко объяснить даже школьнику. Попробую рассказать об этом в контексте эволюционной теории.
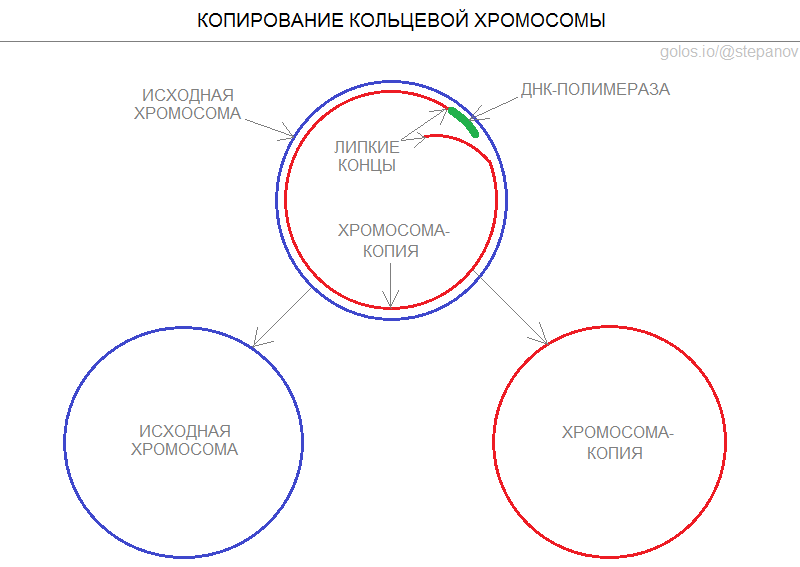
Когда клетка готовится к делению, фермент ДНК-полимераза проходит вдоль хромосомы с целью создания ее копии. Если хромосома имеет кольцевое строение, фермент благополучно завершает полный круг, а концы копии слипаются с образованием хромосомы для новой клетки.
В эпоху одноклеточных организмов хромосомы имели кольцевое строение. Но иногда в результате мутаций случалось так, что концы новой хромосомы не слипались с образованием кольца, и нить ДНК оставалась незамкнутой. Примерно так появились бактерии с линейными хромосомами. Получившая такую хромосому бактерия сталкивалась с проблемой копирования, когда приходил черед ее собственного деления. Полимераза, добежав до конца линейной хромосомы, останавливается и не может скопировать концевой участок, примерно равный собственной длине фермента.
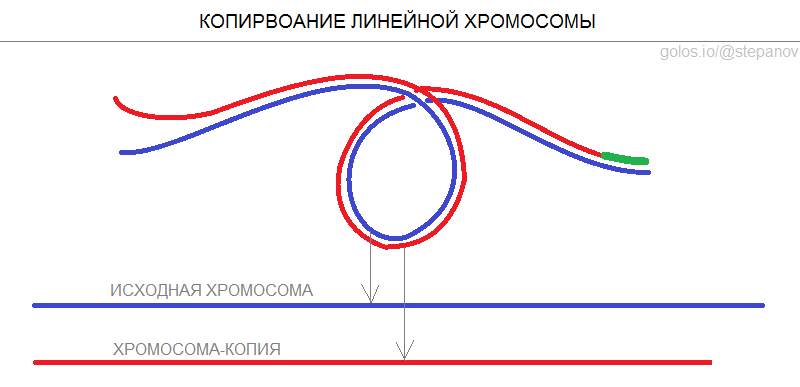
Данная идея озарила Оловникова, когда он спустился в метро после лекции об экспериментах Хейфлика в МГУ. Он рассуждал: "происходящее с полимеразой на линейных хромосомах аналогично тому, как второй вагон поезда никогда не доедет до тупика и остановится на расстоянии равное длине локомотива". Но вернемся к эволюционной теории, чтобы понять, как природа решила проблему бактерий с линейными хромосомами.
Склонность к образованию линейных хромосом могла передаваться по наследству дочерним клеткам, и с каждым поколением геном дочерних бактерий укорачивался. Как только недокопированным оказывался жизненно важный для бактерии ген - колония прекращала рост и погибала. Поэтому первое время бактерии с линейными хромосомами быстро отсеивались в результате естественного отбора.
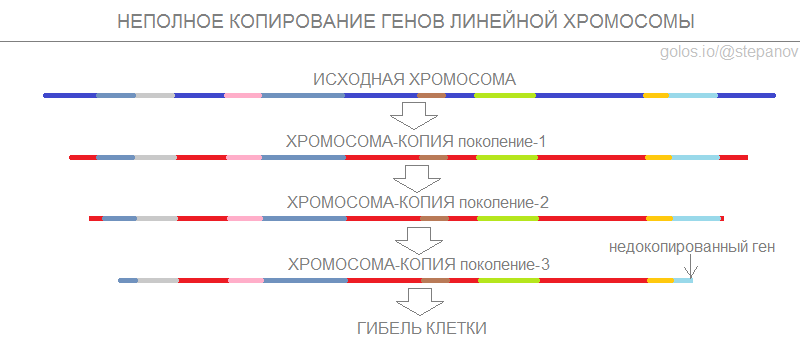
Однако некоторые из таких бактерий в результате случайных вирусных вставок получили дополнительные концы на хромосомах, которые служили своеобразным резервом - данные концевые участки хромосомы могли укорачиваться с каждым делением без угрозы для важных генов. Оловников, предполагая наличие данных участков на концах линейных хромосом человека, назвал их телогенами (совр. назв. - теломеры).
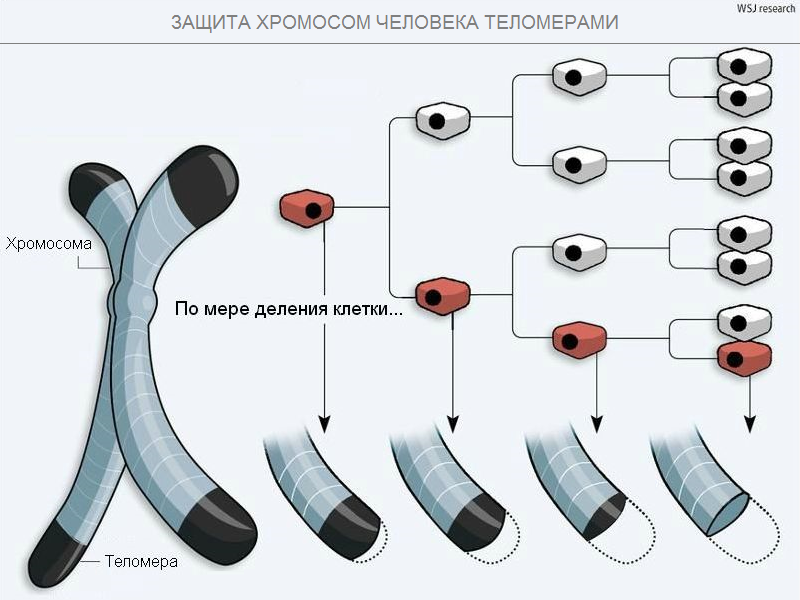
Ок, но ведь и теломеры рано или поздно через 50-100-200 делений израсходуются, и гибель колонии бактерий с линейными хромосомами кажется неизбежной. Более того, линейные хромосомы - единственный вариант организации ДНК и для всех существующих многоклеточных включая человека. Почему на первый взгляд дефектные линейные хромосомы достались высокоразвитым организмам? Предположительно, для первых многоклеточных способность к неограниченному делению оказалось вредна. Только представьте, что ваши клетки беспрепятственно удваиваются, превращая ваше красивое тело в эмбриональную биомассу. А ведь у первых многоклеточных не было иммунной и гормональной систем и других механизмов регулирующих деление клеток. Возможно, поэтому естественный отбор благоприятствовал многоклеточным, которые возникли из одноклеточных с линейными хромосомами.
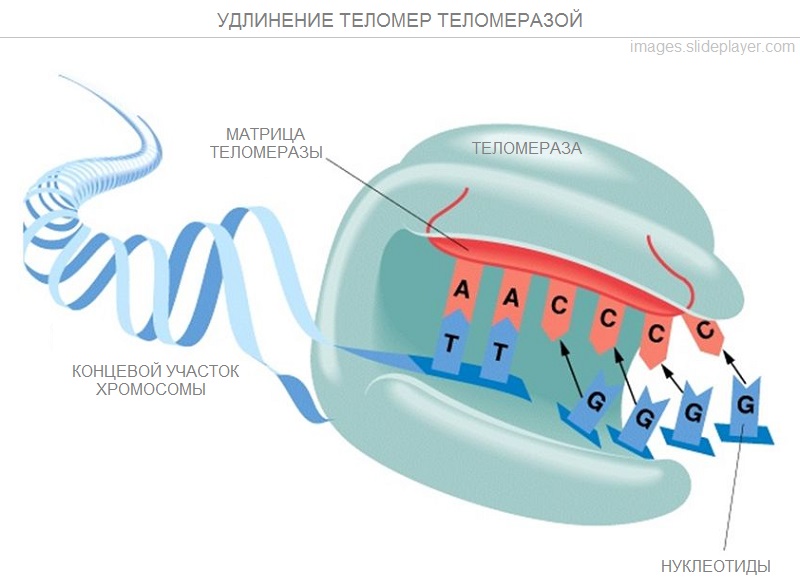
Итак, теломеры конечны, а природа требует продолжения рода. Как объяснить образование организма человека в триллионы клеток из одной зиготы без укорочения теломер? Для разрешения данного противоречия гениальный Оловников предсказал, что теломеры способны наращиваться специальным ферментом, которому дал название тандем-полимераза (совр. назв. - теломераза). Спустя много лет американские ученые экспериментально подтвердили догадки Оловникова и доказали, что теломераза способна прикрепляться к концу хромосомы и, выступая в роли матрицы, наращивать теломеры, за что в 2009 году получили Нобелевскую премию.
Предел Хейфлика в организме человека
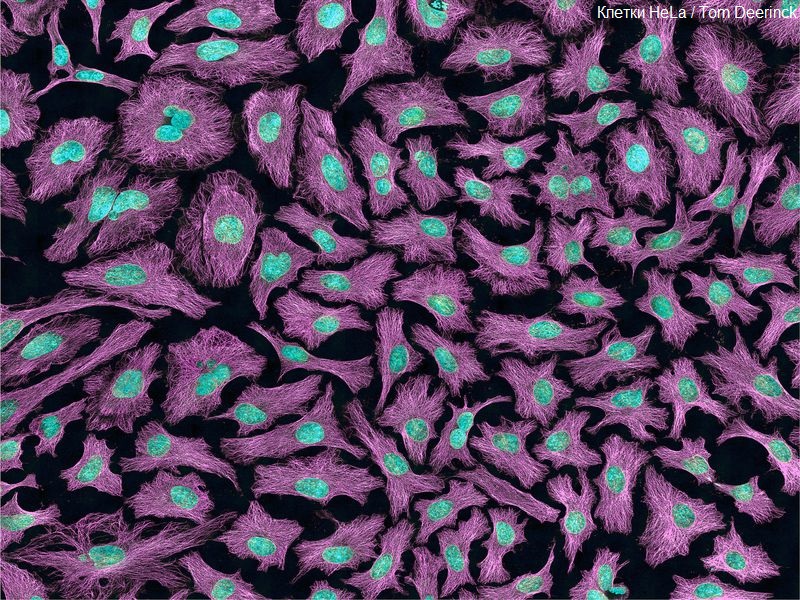
В современных организмах животных и человека проблема предела Хейфлика не так актуальна - до сих пор не удалось установить связь длинны теломер с продолжительностью жизни. Поэтому не стоит спешить платить деньги за исследование длинны теломер. Кроме того данный механизм ограничения деления клеток вряд ли способен остановить рак. Как стволовые, так и раковые клетки легко наращивают теломеры своих хромосом повышая активность теломеразы. Наглядным примером может служить культура клеток, полученная 60 лет назад из опухоли шейки матки американки Генриетты Лакс. Ее клетки до сих пор используют в лабораториях всего мира, они летали в космос и их взрывали атомной бомбой, с их помощью разработаны вакцины и лекарства от рака, а в этом году про них даже сняли художественный фильм. Знаменитые клетки HeLa (от Henrietta Lacks) пережили саму женщину и ее детей, а по своей биомассе многократно переросли массу всех их вместе взятых. Таким образом теломераза легко решает проблему предела Хейфлика.
Кроме того способность стволовых клеток к ассиметричному делению не только решает проблему предела Хейфлика без участия теломеразы, но и проблему накопления мутаций, частота которых увеличивается с каждым делением клетки. Новые данные о делении стволовых клеток создают предпосылки к потенциальному бессмертию не только отдельных клеток, но и всего организма.
Ассиметричное деление - потенциал к бессмертию
Логично, что деление одной клетки заканчивается образованием двух дочерних, одна из которых содержит исходную хромосому, а второй достается ее копия. Даже если речь идет о делении клетки с кольцевой хромосомой, то дочерние клетки не эквивалентны друг другу, так как в процессе копирования ДНК неизбежно происходят ошибки, которые достаются дочерней клетке, получившей копию хромосомы. Если же говорить о делении клеток с линейной хромосомой, то дочерняя клетка получившая копию не только содержит больше мутаций, но и получит укороченные теломеры. Таким образом можно предположить, что через много циклов делений стволовой клетки в организме будет существовать одна клетка с исходной хромосомой, а все остальные будут содержать укороченые копии с мутациями.
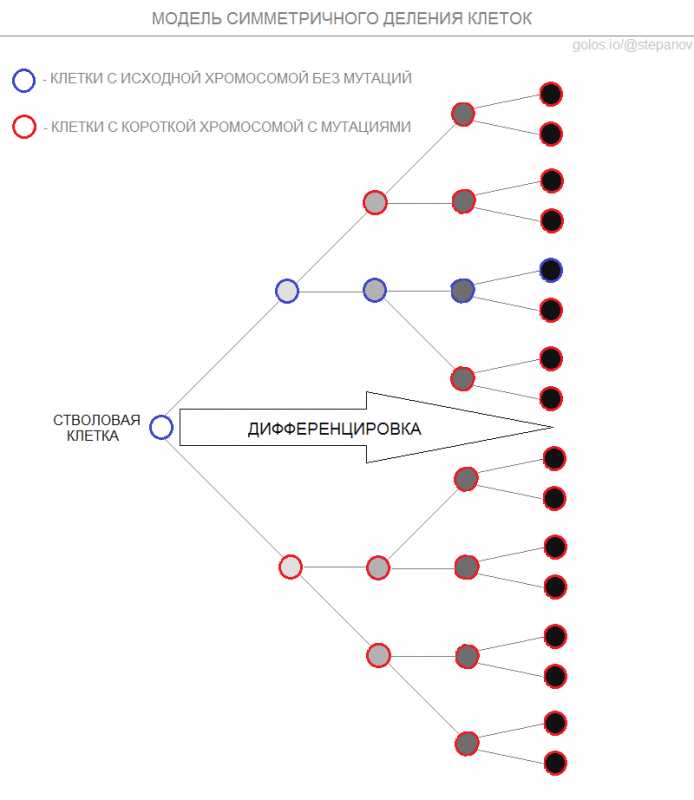
Учитывая, что через несколько циклов делений происходит постепенное созревание (дифференцировка) клеток, то рано или поздно клетка с исходной хромосомой, как и все клетки ее поколения, выполнив свою функцию, погибнет, как ежедневно гибнут миллиарды клеток крови, кожи или эпителия кишечника. При таком раскладе мы вынуждены признать, что все исходные стволовые клетки, запасенные в нашем теле еще в утробе матери, расходуются и с возрастом неизбежно накапливаются мутации, а теломеры неизбежно укорачиваются. Именно так долгое время объяснялось неизбежное дряхление и смертность нашего тела.
Однако в 1975 году была выдвинута гипотеза ассиметричного деления, предполагающая, что деление стволовой клетки заканчивается образованием не двух дочерних клеток, а одной, вторая клетка при этом остается стволовой. В 2010 году экспериментально было подтверждено, что процесс распределения исходной хромосомы и ее копии ассиметричен. Оказалось, что исходные хромосомы остаются в стволовой клетке, которая сохраняет свою стволовость, а копии оказываются в дочерней клетке, которая образует колонию постепенно дифференцирующихся клеток с ограниченным сроком службы.
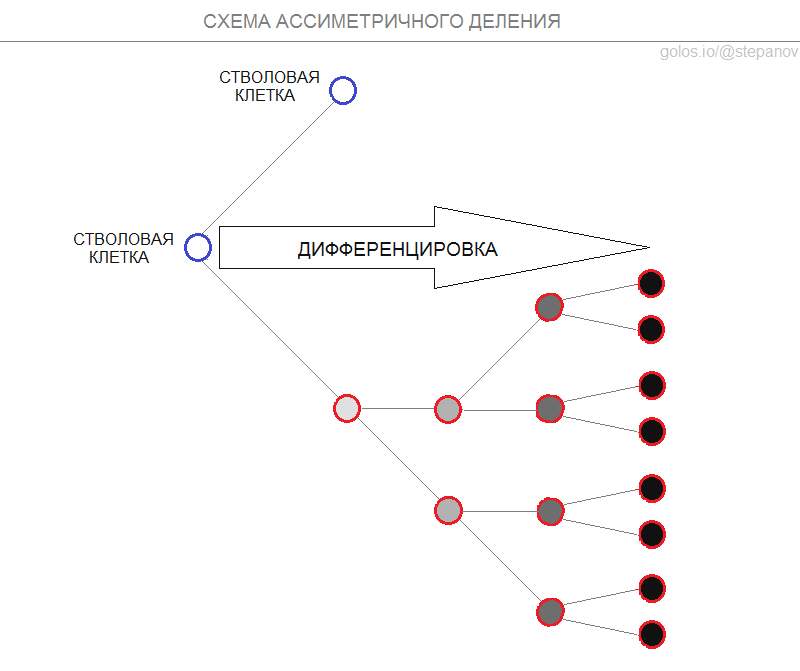
При таком раскладе стволовые клетки обладают буквально неисчерпаемым потенциалом к самоподдержанию:
Сохраняют исходное ДНК не накапливая мутации и не рискуя остаться без теломер;
Редко делятся, мало синтезируют белков и метаболически слабоактивны, а значит легче других клеток переживают недостаток кислорода и питания, интоксикацию и радиацию;
Не дифференцируются в зрелые клетки и не расходуются в течении жизни.
Заключение
В своей лаборатории я выращиваю вот такие гигантские колонии клеток крови всего за 10 дней. Каждое красное пятно - это тысячи молодых эритроцитов, образованных из одной-единственной стволовой клетки. Не исключено, что родоначальница колонии где-то среди них и готова образовать еще не одну такую колонию - достаточно изменить концентрацию гормоноподобных стимуляторов деления.
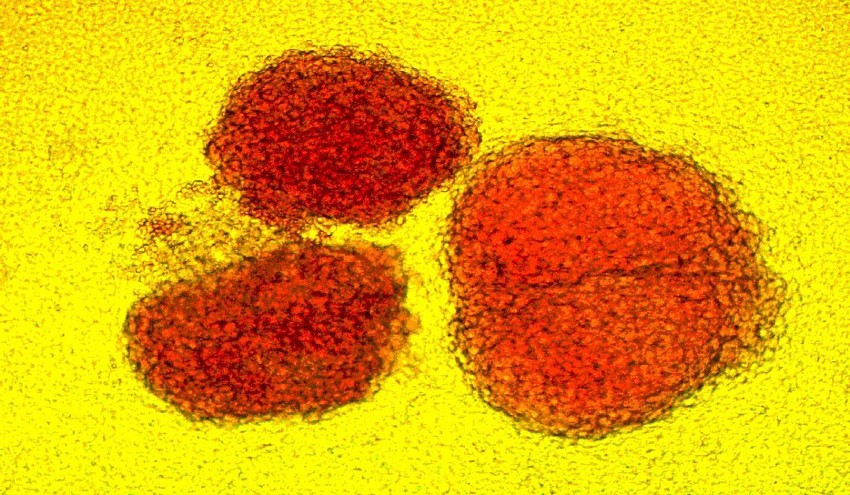
Примерно так это происходит и в костном мозге у каждого из нас в течении жизни. Большинство зрелых клеток крови живут от нескольких минут до нескольких месяцев, поэтому ежедневно требуется возобновление миллиардов клеток крови.
Но почему с возрастом процессы возобновления крови и других тканей организма замедляются? Я придерживаюсь версии, что стволовые клетки остаются жизнеспособными всю нашу жизнь. А замедление процессов регенерации обусловлено "замуровыванием" стволовых клеток соединительными тканями, в результате чего они перестают получать сигналы от макроорганизма о необходимости в обновлении.

Предел Хейфлика
В 1961 году Леонард Хейфлик, наблюдая за культивированием фибробластов человека, обнаружил гибель культуры после 50 делений. Клетки можно было переносить из среды в среду, замораживать на любой срок, но и после размораживания они каким-то образом "помнили" сколько уже произошло делений и делились столько раз сколько осталась до 50. Названное в честь ученого явление - предел Хейфлика - годами оставалось необъяснимым, но уже тогда заговорили про запрограммированную в генах продолжительность жизни человека.
Лишь в 1971 году Алексей Оловников обратил внимание, что предел Хейфлика характерен для клеток с незамкнутой в кольцо ДНК, в то время как бактерии с кольцевой ДНК размножаются без ограничений. Ученый выдвинул гипотезу маргинотомии, которая предполагала, что лимит деления клеток с линейной ДНК обусловлен неполным копированием концевых участков хромосомы в момент деления клетки. Идея Оловникова гениальна и одновременно проста, ее легко объяснить даже школьнику. Попробую рассказать об этом в контексте эволюционной теории.
Когда клетка готовится к делению, фермент ДНК-полимераза проходит вдоль хромосомы с целью создания ее копии. Если хромосома имеет кольцевое строение, фермент благополучно завершает полный круг, а концы копии слипаются с образованием хромосомы для новой клетки.

В эпоху одноклеточных организмов хромосомы имели кольцевое строение. Но иногда в результате мутаций случалось так, что концы новой хромосомы не слипались с образованием кольца, и нить ДНК оставалась незамкнутой. Примерно так появились бактерии с линейными хромосомами. Получившая такую хромосому бактерия сталкивалась с проблемой копирования, когда приходил черед ее собственного деления. Полимераза, добежав до конца линейной хромосомы, останавливается и не может скопировать концевой участок, примерно равный собственной длине фермента.

Данная идея озарила Оловникова, когда он спустился в метро после лекции об экспериментах Хейфлика в МГУ. Он рассуждал: "происходящее с полимеразой на линейных хромосомах аналогично тому, как второй вагон поезда никогда не доедет до тупика и остановится на расстоянии равное длине локомотива". Но вернемся к эволюционной теории, чтобы понять, как природа решила проблему бактерий с линейными хромосомами.
Склонность к образованию линейных хромосом могла передаваться по наследству дочерним клеткам, и с каждым поколением геном дочерних бактерий укорачивался. Как только недокопированным оказывался жизненно важный для бактерии ген - колония прекращала рост и погибала. Поэтому первое время бактерии с линейными хромосомами быстро отсеивались в результате естественного отбора.

Однако некоторые из таких бактерий в результате случайных вирусных вставок получили дополнительные концы на хромосомах, которые служили своеобразным резервом - данные концевые участки хромосомы могли укорачиваться с каждым делением без угрозы для важных генов. Оловников, предполагая наличие данных участков на концах линейных хромосом человека, назвал их телогенами (совр. назв. - теломеры).

Ок, но ведь и теломеры рано или поздно через 50-100-200 делений израсходуются, и гибель колонии бактерий с линейными хромосомами кажется неизбежной. Более того, линейные хромосомы - единственный вариант организации ДНК и для всех существующих многоклеточных включая человека. Почему на первый взгляд дефектные линейные хромосомы достались высокоразвитым организмам? Предположительно, для первых многоклеточных способность к неограниченному делению оказалось вредна. Только представьте, что ваши клетки беспрепятственно удваиваются, превращая ваше красивое тело в эмбриональную биомассу. А ведь у первых многоклеточных не было иммунной и гормональной систем и других механизмов регулирующих деление клеток. Возможно, поэтому естественный отбор благоприятствовал многоклеточным, которые возникли из одноклеточных с линейными хромосомами.
Итак, теломеры конечны, а природа требует продолжения рода. Как объяснить образование организма человека в триллионы клеток из одной зиготы без укорочения теломер? Для разрешения данного противоречия гениальный Оловников предсказал, что теломеры способны наращиваться специальным ферментом, которому дал название тандем-полимераза (совр. назв. - теломераза). Спустя много лет американские ученые экспериментально подтвердили догадки Оловникова и доказали, что теломераза способна прикрепляться к концу хромосомы и, выступая в роли матрицы, наращивать теломеры, за что в 2009 году получили Нобелевскую премию.

Предел Хейфлика в организме человека
В современных организмах животных и человека проблема предела Хейфлика не так актуальна - до сих пор не удалось установить связь длинны теломер с продолжительностью жизни. Поэтому не стоит спешить платить деньги за исследование длинны теломер. Кроме того данный механизм ограничения деления клеток вряд ли способен остановить рак. Как стволовые, так и раковые клетки легко наращивают теломеры своих хромосом повышая активность теломеразы. Наглядным примером может служить культура клеток, полученная 60 лет назад из опухоли шейки матки американки Генриетты Лакс. Ее клетки до сих пор используют в лабораториях всего мира, они летали в космос и их взрывали атомной бомбой, с их помощью разработаны вакцины и лекарства от рака, а в этом году про них даже сняли художественный фильм. Знаменитые клетки HeLa (от Henrietta Lacks) пережили саму женщину и ее детей, а по своей биомассе многократно переросли массу всех их вместе взятых. Таким образом теломераза легко решает проблему предела Хейфлика.

Кроме того способность стволовых клеток к ассиметричному делению не только решает проблему предела Хейфлика без участия теломеразы, но и проблему накопления мутаций, частота которых увеличивается с каждым делением клетки. Новые данные о делении стволовых клеток создают предпосылки к потенциальному бессмертию не только отдельных клеток, но и всего организма.
Ассиметричное деление - потенциал к бессмертию
Логично, что деление одной клетки заканчивается образованием двух дочерних, одна из которых содержит исходную хромосому, а второй достается ее копия. Даже если речь идет о делении клетки с кольцевой хромосомой, то дочерние клетки не эквивалентны друг другу, так как в процессе копирования ДНК неизбежно происходят ошибки, которые достаются дочерней клетке, получившей копию хромосомы. Если же говорить о делении клеток с линейной хромосомой, то дочерняя клетка получившая копию не только содержит больше мутаций, но и получит укороченные теломеры. Таким образом можно предположить, что через много циклов делений стволовой клетки в организме будет существовать одна клетка с исходной хромосомой, а все остальные будут содержать укороченые копии с мутациями.

Учитывая, что через несколько циклов делений происходит постепенное созревание (дифференцировка) клеток, то рано или поздно клетка с исходной хромосомой, как и все клетки ее поколения, выполнив свою функцию, погибнет, как ежедневно гибнут миллиарды клеток крови, кожи или эпителия кишечника. При таком раскладе мы вынуждены признать, что все исходные стволовые клетки, запасенные в нашем теле еще в утробе матери, расходуются и с возрастом неизбежно накапливаются мутации, а теломеры неизбежно укорачиваются. Именно так долгое время объяснялось неизбежное дряхление и смертность нашего тела.
Однако в 1975 году была выдвинута гипотеза ассиметричного деления, предполагающая, что деление стволовой клетки заканчивается образованием не двух дочерних клеток, а одной, вторая клетка при этом остается стволовой. В 2010 году экспериментально было подтверждено, что процесс распределения исходной хромосомы и ее копии ассиметричен. Оказалось, что исходные хромосомы остаются в стволовой клетке, которая сохраняет свою стволовость, а копии оказываются в дочерней клетке, которая образует колонию постепенно дифференцирующихся клеток с ограниченным сроком службы.

При таком раскладе стволовые клетки обладают буквально неисчерпаемым потенциалом к самоподдержанию:
Сохраняют исходное ДНК не накапливая мутации и не рискуя остаться без теломер;
Редко делятся, мало синтезируют белков и метаболически слабоактивны, а значит легче других клеток переживают недостаток кислорода и питания, интоксикацию и радиацию;
Не дифференцируются в зрелые клетки и не расходуются в течении жизни.
Заключение
В своей лаборатории я выращиваю вот такие гигантские колонии клеток крови всего за 10 дней. Каждое красное пятно - это тысячи молодых эритроцитов, образованных из одной-единственной стволовой клетки. Не исключено, что родоначальница колонии где-то среди них и готова образовать еще не одну такую колонию - достаточно изменить концентрацию гормоноподобных стимуляторов деления.

Примерно так это происходит и в костном мозге у каждого из нас в течении жизни. Большинство зрелых клеток крови живут от нескольких минут до нескольких месяцев, поэтому ежедневно требуется возобновление миллиардов клеток крови.
Но почему с возрастом процессы возобновления крови и других тканей организма замедляются? Я придерживаюсь версии, что стволовые клетки остаются жизнеспособными всю нашу жизнь. А замедление процессов регенерации обусловлено "замуровыванием" стволовых клеток соединительными тканями, в результате чего они перестают получать сигналы от макроорганизма о необходимости в обновлении.

Источник: polonsil.ru
Комментарии (0)
{related-news}
[/related-news]